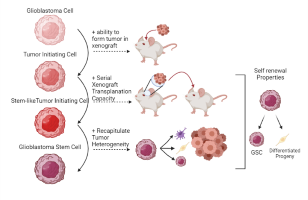
肿瘤干细胞
肿瘤干细胞是肿瘤组织中一群具有自我更新、快速增殖,多向分化潜能、能够启动和重建肿瘤组织表型能力的癌细胞。肿瘤干细胞参与肿瘤的转移、复发,促进肿瘤血管新生, 耐受化疗和放疗以及逃避免疫细胞的监视。靶向肿瘤干细胞的治疗策略将有可能给癌症的治疗带来新的希望。谢琦博士和谢琦实验室一直从事肿瘤干细胞的表观遗传学(Cell, 2018),转录调控水平(JCI, 2016),翻译后修饰水平(Nature Neuroscience, 2015)以及代谢水平(Cancer Discovery, 2019)的系统性研究,以及近期对肿瘤干细胞和所在肿瘤微环境相互作用的研究(Cell Research, 2020)。这些研究可能推动癌症干细胞的靶向疗法或免疫疗法,以改善癌症治疗。
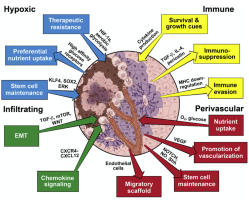
肿瘤微环境
肿瘤微环境(Tumor microenvironment)一直是抗癌治疗中的一个重要课题。谢琦实验室旨在研究胶质母细胞瘤(Glioblastoma)和肿瘤微环境之间的相互作用,特别是肿瘤相关巨噬细胞(Tumor-associated Macrophage)和T细胞。团队利用CRISPR/Cas9文库筛选及单细胞测序等手段,筛选调控免疫应答得基因,以增强免疫浸润并抑制肿瘤进展和侵袭,达到进一步了解肿瘤微环境和改善胶质母细胞瘤治疗效果的目的。
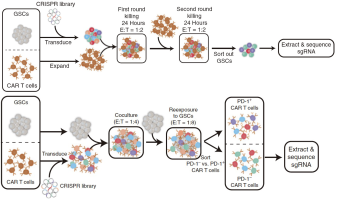
免疫疗法
随着CAR-T在血液瘤治疗中取得了重要的临床效果,治疗型CAR-NK以及CAR-macrophage作为一类潜在的新兴肿瘤靶向技术,也得到了极大的关注。在谢琦导师的实验室,研究团队致力于建立起一个通过CRISPR/Cas9基因修饰、iPSC诱导的免疫细胞平台。同时,团队利用现有成熟的CRISPR screening技术,筛选有利于提高iPSC分化效率及增强抗肿瘤效果的关键基因和相关通路。另一方面,溶瘤病毒可以选择性的杀死肿瘤细胞,并能够持续性体内引起免疫应答。因此,溶瘤病毒和CAR免疫细胞技术的结合可成为更为精准、快速、高效的肿瘤治疗方案。
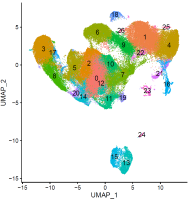
生物大数据分析
随着生物技术的发展,各种生物信息分析手段也随之而来。谢琦实验室广泛利用各种分析手段,包括单细胞RNA测序,单细胞ATAC测序,单细胞ChIP测序,以及CRISPR筛选,外显子测序,等手段,对胶质母瘤细胞的肿瘤微环境,生成与发展,以及对其分子机制进行更深入的了解,并为后面进一步实验验证提供切入点。同时,团队也和其他生物信息组密切合作,利用最新工具对胶质母瘤细胞的干细胞生成机制进行深入的探索与研究。
